KİMYASAL BAĞLAR
Kimyasal bağlardan daha önce, kimyasal bağ kavramının tarihsel gelişimi başlığında bahsetmiştik. Tekrar incelemeniz faydalı olacaktır.
- Kimyasal bağlar atomları bağlar ve bileşiklerin oluşmasını sağlar.
- Kimyasal bağlar atomlardaki artı ve eksi yüklerin birbirini çekmesi sonucu oluşur. Fiziksel bağlar da (moleküller arası etkileşimler) aynı sebeple oluşur.
- Kimyasal bağlarda çekim gücü daha küvvetlidir, fiziksel bağlarda daha zayıftır. (Fiziksel bağlar, başka bir ünitenin konusudur. Bu yüzden şimdilik, fiziksel bağları es geçiyoruz.)
- İyonik bağ
- Kovalent bağ
Arkadaşlar, her iki kimyasal bağ da metal ve ametal atomlarının elektorn düzenlerini soygaz atomlarınınkine benzetme çabaları sonucu oluşur. İki atom bu amaçla ya iyonik bağ ya da kovalent bağ kurar.
Soygazların elektron düzenlerinde özel olan şey son yörüngeleridir. Atlı tane soygazdan He'un elektron düzeni diğerlerinden farklıdır. Çünkü He soygazının çok az elektronu vardır, sadece 2 elektrona sahiptir. Bu yüzden He dubletini tamamlamış ve kararlı bir soygazdır. Elektron dağılımı da şöyledir:
Arkadaşlar metal ya da ametal atomlarının da bi şekilde elektron sayıları 2 olursa, bu atomlar dubletini tamamlamış olur.
Diğer soygazların, değerlik tabakalarında (son yörüngelerinde) ise 8 elektron bulunur. Bu yüzden diğer soygazlar oktetlerini tamamlamıştır. Metal ya da ametal atomlarının da bir şekilde değerlik elektron sayısı 8 olursa, bu atomlar da oktetini tamamlamış olur.
- Metal atomları oktet ya da dublet tamamlamak için elektron verirler.
- Ametal atomları ise oktet ya da dublet tamamlamak için elektron alır ya da ortaklaşırlar.
İyonik Bağ
- İyonik bağ; bir metal atomu ile bir ametal atomu arasında kurulur.
- İyonik bağda, metal ve ametal atomları elektron alış-verişi yaplar. Bu sayede dublet ya da oktetlerini tamamlayıp kararlı olurlar.
- Metal atomlarının son yörüngelerinde 1, 2 veya 3 tane elektron vardır. (Hidrojen burada bir istisnadır. Sadece 1 tane elektronu olmasına rağmen bir amtaldir.)
- Ametal atomlarının son yörüngelerinde 5, 6 veya 7 tane elektron vardır. (Soygazları dikkate almazsak tabi ki de)
- Metaller, iyonik bağ yapmak için son yörüngelerindeki elektronların genellikle hepsin vererek oktet ya da dublet tamamlarlar.
- Ametaller ise, iyonik bağ yapmak için metallerin verdiği elektronları alarak oktetlerini tamamlar. (Sadece hidrojen ametali, elektron alıp dublet tamamlar)
- Arkadaşlar; iyonik bağ kurulmadan önce, metal atomu da ametal atomu da nötürdür. Yani elektron sayıları, proton sayılarına eşittir.
- İyonik bağ kurmak için metal atomu, elektron verdiğinden, + yüklenir ve katyon olur.
- İyonik bağ kurmak için ametal atomu da elektron aldığından, - yüklenir ve anyon olur.
- Biri artı diğeri eksi ise birbirlerini çekmeleri de tabi ki kaçınılmazdır. İşte bu iki zıt yüklü iyon arasındaki çekim kuvvetine iyonik bağ denir.
Haydi, sodyum (Na) metali ile klor (Cl) ametalinin aralarında kurdukları iyonik bağı yakından izleyelim:
İyonik Bağlı Bileşiklerin Özellikleri:
- İyonik bağ, bütün bağların en kuvvetlisidir. Bu yüzden iyonik bileşikler tabiatta hep katıdır, erime ve kaynama noktaları genellikle çok yüksektir.
- İyonik bağ, kristal yapıları oluşturur. Bu yüzden iyonik bağlı bileşikler, kristallerden oluşur, moleküllerden değil. Arkadaşlar kristal yapı demek, iyonik bileşikteki metal katyonu (+ iyon) ile ametal anyonunun (- iyon) sırayla dizilimesi demektir:
 |
| Yemek Tuzunun Kristal Yapısı |
- İyonik bileşikler, suda iyonlarına ayrışarak çözünürler. Bu yüzden, iyonal çözeltiler oluştururlar. Yani çözeltileri elektrik akımını iletir.
- İyonik bileşikler, kırılgandır, ufalanırlar ve toz haline gelirler. Tel veya levha olamazlar.
- Katı halde iken elektriği iletmezler ama sıvı halde iken ya da sulu çözelti iken elektrik akımını iletirler.
- NaCl(k) : Katı tuz demektir ve elektriği iletmez.
- NaCl(s) : Sıvı tuz demektir ve elektriği iletir.
- NaCl(suda) : Suda çözünmüş tuz demektir ve elektriği iletir.
- NaCl(g) : Gaz halinde tuz demektir ve elektriği iletmez.
Kovalent Bağ
- Kovalent bağ, aynı ya da farklı iki ametal atomunun aralarında kurduğu kimyasal bağdır.
- Metallerin kovalent bağ yetenekleri yoktur.
- Kovalent bağ kurmak için ametal atomları, değerlik elektronlarıdan birer tanesini karşısındaki atom ile ortaklaşa kullanır. Yani ortaya konulmuş iki elektron bir kovalent bağ oluşması demektir.
- Ortaya konulan elektronlar her iki atomun protonları tarafından da çekilir ve atomlar birbirine bağlanmış olur.
- Bir ametal, oktet ya da dublet tamamlamak için kaç elektron lazımsa o kadar elektronunu ortaklaşa kullanılır.
- Elektronlarını ortaklaşa kullanmak demek, genellikle atomların son yörüngelerini kesiştirip, bu kesişim bölgesine birer, ikişe ya da üçer elektron koymaları demektir.
- İki atom birer elektronlarını ortaklaşa kullanırsa 1 kovalent bağ, ikişer elektronlarını ortaklaşa kullanırsa 2 kovalent bağ, üçer elektronlarını ortaklaşa kullanırsa 3 kovalent bağ kurmuş olurlar.
Görüldüğü gibi değerlik tabakasında 6 elektron var. 8'e tamamlamak için iki tane daha lazım... Bu yüzden oksijen iki elektronunu ortaya atar ve iki tane kovalent bağ yapar.
Hidrojen ise bir kovalent bağ yaptığında dubletini tamalamış olur.
Oksijen atomu iki tane hidrojen atomu da bir tane kovalent bağa ihtiyaç duyduğundan, bu iki ametalin oluşturacağı molekülün formülü H2O olacaktır. Biz bu moleküle su diyoruz :)
Oksijen atomu iki tane hidrojen atomu da bir tane kovalent bağa ihtiyaç duyduğundan, bu iki ametalin oluşturacağı molekülün formülü H2O olacaktır. Biz bu moleküle su diyoruz :)
Şimdi, hidrojen ve oksjienin oktet ve dubletlerini, kovalent bağ sayesinde nasıl tamamlayıp su molekülünü oluşturduklarını görelim:
Karbon atomu (C), değerlik elektron sayısı 4 olan bir ametal atomudur. Oktet için 4 elektrona ihtiyacı olduğundan, 4 elektronunu ortaklaşa kullanır ve 4 kovalent bağ yapmış olur.
Hidrojen ise 1 elektronu olan ve dublet için 1 elektrona ihtiyaç duyan bir ametaldir. Bu yüzden 1 tane elektron ortaklaşır, yani 1 tane kovalent bağ yapar.
Karbon 4 tane bağ, hidrojen 1 tane bağ yaptığı için, bir karbona dört hidrojen gerekecektir. Bu yüzden bu iki ametalin oluşturacağı molekülün fürmülü CH4 olacaktır.
Şimidi CH4 melekülündeki kovalent bağlara yakından bakalım:
Aşağıda CO2 molekülünü görüyorsunuz:
Yukarıda, karbondioksit molekülünün bağ yapısı vardır. Dikkat edersek, karbon 4 bağ ihtiyacının ikisini bir oksijenle, ikisini de diğer oksijenle karşılamıştır. Oksijenlere zaten iki bağ yetiyordu.
Yukarıda görüldüğü gibi, iki atom arasında iki tane kovalent bağ da kururlabilir. Bunun için atomların ikiler elektronlarını ortaklaşması gerekir.
Azotun, değerlik elektron sayısı 5'tir. Oktet için 3 tane daha elektron gerekmektedir. Bu da azot ametalinin 3 kovalent bağ kuracağı anlamına gelir.
Aşağıda iki azot atomunun (N2 molekülünün) kovalent bağ yapısı verilmiştir:
İki oksijen atomu da kendi aralarında oktet tamalayabilir ve bunun için iki kovalent bağ kurmaları yeterli olur. Aşağıda O2 molekülünün kovalent yapısı:
 |
| Karbon ve Hidrojen Ametalleri Arasında Kovalent Bağlar ile Kurulan CH4 Molekülü |
 |
| Karbondioksit Molekülünün Kovalent Bağları |
Yukarıda görüldüğü gibi, iki atom arasında iki tane kovalent bağ da kururlabilir. Bunun için atomların ikiler elektronlarını ortaklaşması gerekir.
Azotun, değerlik elektron sayısı 5'tir. Oktet için 3 tane daha elektron gerekmektedir. Bu da azot ametalinin 3 kovalent bağ kuracağı anlamına gelir.
Aşağıda iki azot atomunun (N2 molekülünün) kovalent bağ yapısı verilmiştir:
 |
| İki Azot Atomu, Üçer Elektron Ortaklaşır ve 3 Tane Kovalent Bağ Kurmuş Olur |
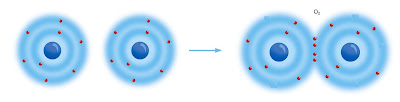 |
| İki Oksijen Atomu İkişer Elektronunu Ortaklaşa Kullanıp İki Kovalent Bağ Kurar |
Klor atomunun değerlik elektron sayısı 7'dir. Bunun anlamı da oktet için 1 elektrona ihtiyacının olmasıdır. Bu yüzden klor atomları 1 kovalent bağ kurmak ister. Aşağıda iki klor atomunun (Cl2) kovalent bağ yapısı verilmiştir:
Aşağıdaki animasyonda, H ametalinin dubletini tamamlamak için kardeşi ile yaptığı kovalent bağ gösterilmiştir. H2 molekülü böyle oluşmaktadır:
 |
| Klor Atomları 1 Tane Kovalent Bağ Kurarak Oktetlerini Tamamlarlar |
Kovalent Bağlı Bileşiklerin Özellikleri:
- İki ya da daha fazla atom, aralarında kovalent bağ kurunca bir molekül oluşturmuş olurlar.
- Bu yüzden, kovalent bağlı bileşiklerin tanecikleri moleküllerdir. Bir başka ifadeyle, kovalent bileşikler moleküllerden oluşur.
- Tabiatta, katı, sıvı ya da gaz halinde kovalent bileşikler vardır.
- Bazıları iyonlarına ayrışarak (kuvvetli asitler mesela) bazıları da moleküler halde (şeker bileşiği mesela) çözünürler.
Kovalent Bağda Polarlık ve Apolarlık
- Arkadaşlar, kovalent bağ genellikle bir tire (-) işaretiyle gösterilir.
- Aynı iki ametal atomu arasındaki kovalent bağ apolardır.
H-H arasındaki kovalent bağ
Cl-Cl arasındaki kovalent bağ
O=O arasındaki kovalent bağların ikisi de
C≡C arasındaki kovalent bağların üçü de
aporlar kovalent bağdır. Çünkü kovalent bağları kuran atom çiftleri birbirinin aynısıdır.
- Farklı iki ametal atomu arasındaki kovalent bağ polardır.
H-Cl arasındaki kovalent bağ
C=O arasındaki kovalent bağların ikisi de
C≡N arasındaki kovalent bağların üçü de
porlar kovalent bağlıdır. Çünkü kovalent bağları kuran atom çiftleri birbirinden farklıdır.
- Arkadaşlar polar kelimesi kutuplu anlamında bir kelimedir.
- Bu yüzden polar kovalent bağların artı ve eksi kutupları vardır. Şöyle düşünün: Polar kovalent bağlar, iyonik bağları taklit etmeye çalışırlar. Ama bir iyonik bağda olduğu gibi net artı ve eksi yükler oluşturamazlar.
- Polar bir kovalent bağın bir ucunadaki atom kısmi negatif (δ-), diğer ucundaki atom da kısmi pozitif (δ+) yüklüdür.
- Peki, kovalent bağın hangi tarafı kısmi negatif, hangi tarafı kısmi pozitif kutuptur? Bunun cevabı da basittir: Daha aktif olan ametalin olduğu uç kısmi negatif, diğer taraf da kısmi pozitif kutuptur.
- En aktif ametal flor (F) ametalidir. Periyodik tabloda flora daha yakın olan ametal de uzak olanlardan daha aktirftir.
- Aktif olan ametal demek elektronegativite kuvveti fazla olan ametal demektir.
- Elektronegativite kuvveti ise, bir atomum bağ elektronlarını kendine doğru çekme kuvvetidir.
- Tabi ki bağ elektronları, daha kuvvetli çeken ametale daha yakın olacaktır. Bu durum, o ametalde, tam değil de kısmen eksi yük oluşmasına sebep olacaklardır. Diğer ametal de elektronu kendisinden uzaklaştığı için kısmen pozitif yüklü olacaktır.
Sigma (σ) ve Pi (Π) Bağları
- Arkadaşlar iki ametal atomu arasında, bazen 1 tane, bazen iki tane, en fazla da 3 tane kovalent bağ kurulabilir.
- İşte, iki ametal arasında kurulan ilk kovalent bağ sigma bağıdır.
- İki ametal arasında kurulan ikinci ve üçüncü kovalent bağlar ise pi bağlarıdır.
- Kısaca, iki atom arasında önce bi tane sigma bağı kurulur. Varsa ikinci ve üçüncü kovalent bağların her biri pi bağıdır.
H-H molekülünde hidrojen atomları arasında bir tane kovalent bağ vardır o da sigma bağıdır.
O=O melkülünde ise iki oksijen atomu arasında 2 tane kovalent bağ vardır. Bunlardan biri sigma diğeri pi bağıdır. Arkadaşlar, hangisinin sigma hangisinin pi bağı olduğu önemli değildir.
N≡N molekülünde ise iki azot atomu arasında 3 tane kovalent bağ kurulmuştur. Birincisi tabi ki de sigma, ikinci ve üçüncüsü de pi bağlarıdır.
Mesela;
H-C≡C-H molekülünde toplam 3 tane sigma bağı 2 tane pi bağı vardır.
Kimya Basittir: Arkadaşlar genellikle moleküldeki atomların sayısından bir eksik sayda sigma bağı vardır. Mesela yukarıdaki örnekte verdiğimiz H-C≡C-H molekülünde 4 tane atom vardır, bu yüzden sigma bağı sayısı 3 tanedir.
- Pi bağları, sigma bağlarından daha zayıftır.
- Tek kovalent bağ ikili kovalent bağdan daha kolay, ikili kovalent bağ da üçlü kovalent bağdan daha kolay kopar. En sağlam bağ üçlü kovalent bağdır. Yani; C≡C en sağlam, C=C daha zayıf ve C-C en zayıf bağlı karbon çiftleridir.



Hiç yorum yok:
Yorum Gönder